|
進行膵癌に対して現在行われている治療からは、貧しい結果しか得られていない。多くの化学療法のレジメンは5%またはそれ以下の他覚的奏効率を得るのみである。どのような治療を行っても、生存期間は5〜6ヵ月の範囲であり、1年生存率は20%以下である。従来の治療法によるこの悲惨な結果は、研究者らに、進行膵癌患者の奏効率と生存期間を改善する可能性をもつ新しい治療法を探求させることとなった。
研究者らはゲムシタビンと葉酸拮抗剤であるpemetrexedを加えた併用療法の臨床的有用性を評価した。Pemetrexedはヒト癌クローニングアッセイ法で膵癌の検体に対して有効性を示した。この薬剤はまた、限られた臨床評価ではあるが、膵癌と大腸癌に対して有効性の証拠を示した。Pemetrexedとゲムシタビンはin
vitroの実験系で相乗効果を発揮した。そしてゲムシタビン/pemetrexedは併用による第I相試験で21%の他覚的奏効率を得た。
9センターからの研究者らは前治療のない進行膵癌42例を登録した。治療方法はゲムシタビン1,250mg/m2を第1日と8日に、そしてpemetrexed
500mg/m2を第8日に投与し、これを21日毎に繰り返した。全症例は全体として213サイクル投与され、1例あたりの投与回数(中央値)は4サイクルであった。多くの症例は、葉酸とビタミンB12の補助的投与を受けた。これは研究者らが、これら薬剤の補助的投与がpemetrexedの毒性を有意に減少させることを知ったためである。
この併用療法は、評価可能な41例中5例(12%)のpartial response(PR)を得た。これに加えて3例の未確認のPR例を含む18例(44%)がstable
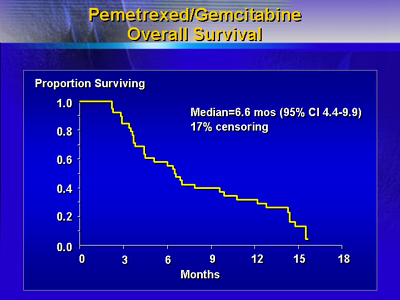
disease(SD)となった。全症例の生存期間(中央値)は6.6ヵ月で、無増悪期間(中央値)は3.1ヵ月であった。症例は毎週、performance
status、痛みのスコア、鎮痛剤の使用量、そして体重を含む臨床的有用効果(clinical benefit response)が評価された。30例のclinical
benefitの分析で、13.3%のclinical benefit responseが認められた。
|
ゲムシタビン/pemetrexed併用療法の臨床効果
|
パラメーター | - | |
Partial Response |
5 (12%) | Stable
Disease |
18(44%) | 生存期間(中央値) | 6.6ヵ月 | 無増悪期間(中央値) |
3.1ヵ月 | 1年生存 | 32% | Clinical
Benefit Response | 4
(13.3%) |
奏効までの期間 | 2週 | 奏効期間 | 6.5週 |
|
ゲムシタビン/pemetrexedは大部分の症例に血液毒性を発生させた。Grade3-4の好中球減少は84%の症例に、grade3-4の白血球減少は74%に、そしてgrade3-4の血小板減少は33%に発現した。比較的少数の症例が高度の非血液毒性を経験した。それらは下痢2%、悪心5%、倦怠4%、ビリルビンの上昇2%、肝酵素上昇(ALTまたはAST)24%、そしてアルカルフォスファターゼの上昇7%であった。
この研究結果は、ゲムシタビン/pemetrexedは進行膵癌に臨床的活性をもつこと、そしてこの併用療法が耐容可能な毒性プロフィールをもつことも示している。
|
レポーター:
Charles Bankhead
| | 日本語翻訳・監修: | 愛知県健康づくり振興事業団副理事長
愛知県がんセンター名誉総長
小川一誠 |
|