|
ゲムシタビンは有効性が10%より低い奏効率と6ヵ月以内の生存期間(中央値)という成績にもかかわらず、膵癌に対しての化学療法剤として最も広く投与される薬剤のひとつである。ゲムシタビン/ドセタキセルの併用はin
vitroの実験で相乗的な作用を示し、そしてドセタキセル/シスプラチンも同じ系で相乗的であった。
17のセンターの研究者らは、2つのドセタキセルを含む併用療法を進行膵癌の96例で比較研究した。各グループの約80%の症例は転移病変を有していた。ゲムシタビン800mg/m2を第1日と8日に、ドセタキセル85mg/m2を第8日に併用するゲムシタビン/ドセタキセル群と、シスプラチン75mg/m2とドセタキセル75mg/m2を第1日に投与するシスプラチン/ドセタキセル群に無作為化割り付けされた。症例は3週ごとのサイクルで治療を受けた。
ゲムシタビン/ドセタキセルの併用がより良い耐容性を示した(表参照)。ゲムシタビン/ドセタキセル群は中央値が4サイクルの治療を受けたのに対して、ドセタキセル/シスプラチン群は2サイクルであった。このドセタキセル/シスプラチン群のかなり多くの症例は毒性のために治療が中止された。そしてゲムシタビン/ドセタキセル群ではより多くの症例が6サイクル以上の治療を受けた。
毒性の頻度
-
| G-D | D-C | 好中球減少(grade3-4) | 24.4% | 34.2% | 発熱性好中球減少 | 6.6% | 17.1% |
血小板減少 | 8.9% | 2.4% | 貧血 | 13.4% | 14.6% | 神経障害 | 6.7% | 17.1% | 嘔吐 | 2.2% | 14.6% | 浮腫 | 4.4% | 0% | 下痢 | 4.4% | 7.3% | 治療中止−毒性のため | 15% | 26% | 6サイクル以上治療 | 44% | 29% |
G-D=ゲムシタビン/ドセタキセル, D-C=ドセタキセル/シスプラチン
|
研究者らは、ゲムシタビン/ドセタキセル群の38例とドセタキセル/シスプラチン群の31例で有効性の評価が可能であった。ゲムシタビン/ドセタキセル群では6例のPartial
Response(PR)と14例のStable Disease(SD)が得られた。ドセタキセル/シスプラチンン群では5例のPRと13例のSDであった。
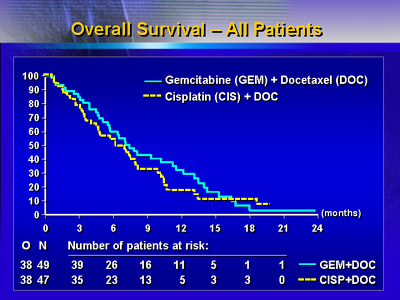
ゲムシタビン/ドセタキセルの併用は生存期間(中央値)が7.4ヵ月であり、一方ドセタキセル/シスプラチンの併用では6.3ヵ月であった。無増悪期間の分析では、ゲムシタビン/ドセタキセルは無増悪期間(中央値)が3.6ヵ月とわずかであるが、ドセタキセル/シスプラチンの2.8ヵ月より優れていた。
この結果は、双方の併用療法が進行膵癌に有効性をもつことを確認している。研究者らは、双方の併用療法の毒性は予知可能で治療可能であることを見出した。しかしながら、ゲムシタビン/ドセタキセルの併用療法がより好ましい毒性のプロフィールであった。
ゲムシタビン/ドセタキセルの併用療法は、ゲムシタビン単独で治療された症例で認めらた生存期間とhistoricalに比較して、よりすぐれた生存期間(中央値)を得たように思われる。この研究結果はゲムシタビン/ドセタキセルの有効性と耐容性をゲムシタビン単独療法と比較する無作為化比較臨床試験を行うことを正当化している。
|
レポーター:
Charles Bankhead
| | 日本語翻訳・監修: |
愛知県健康づくり振興事業団副理事長
愛知県がんセンター名誉総長
小川一誠 |
|