|
糖尿病を有していると心臓は左室肥大を呈しやすい。肥大を抑制する鍵となるメカニズムはサイクリックGMPである。このメカニズムはBNPの内皮細胞に依存しない活性を仲介する。サイクリックGMPはまた、アンジオテンシン変換酵素(ACE)阻害薬の肥大抑制効果にも寄与するようである。
糖尿病は内皮細胞に依存した経路をも危険にさらす。特に糖尿病は内皮細胞のnitric oxide機能を損じさせやすい。Nitric
oxideは虚血傷害から心筋を保護する働きをもつことから、このことは重要な結果をもたらしうる。
Ritchie博士らは、糖尿病がどのようにしてラットの心臓においてBNPの急性期肥大抑制活性に影響を与えるかを評価した。彼らはこれをブラジキニン、ACE阻害薬(ramiprilat)、neutral
endopeptidase(NEP)阻害薬(candoxatrilat)の活性と比較した。彼らは、BNPの肥大抑制活性は保存されておりACE阻害薬の肥大抑制活性は保存されていないであろう、と仮定した。
まず、糖尿病ラット、および同年齢のコントロールラットから心臓が単離された。これらの心臓は90分間BNP、ブラジキニン、ramiprilat、candoxatrilat、または溶媒で灌流された。最初の30分が経った後アンジオテンシンIIが加えられ、続いて60分間放射性化合物([3H]phenylalanine)が混和された。
次に、phenylalanineの取り込み分析により蛋白合成のレベルが決定された。また、radioimmunoassayを使って心房性ナトリウム利尿ペプチド(ANP)とβミオシン重鎖のmRNA発現が測定された。
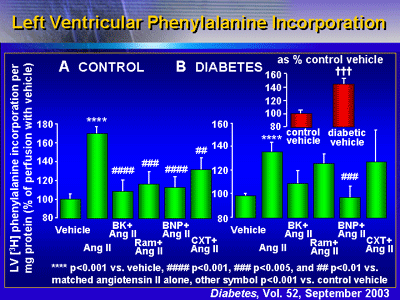
蛋白合成
結果は、これら糖尿病ラットの心臓においてBNPが蛋白合成を阻害することを示していた。糖尿病ではないラットの心臓(コントロール)においては、アンジオテンシンIIは左室のphenylalanineの取り込みを溶媒のみ灌流した群と比較して170%増加させた。ブラジキニン、ramiprilat、BNPとcandoxatrilatは全てこの刺激を阻害した。糖尿病ラットの心臓においては、phenylalanineの取り込みはコントロールと比較して143%高かった。アンジオテンシンIIは、糖尿病ラットの心臓において投与しなかった群の心臓と比べてphenylalanineの取り込みをさらに137%促進した。重要なことは、BNPがこの肥大反応を完全に失わしめたことである(アンジオテンシンII単独と比較してp<0.001)。その他の治療(ブラジキニン、ramiprilat、candoxatrilat)はこの反応を止められなかった。
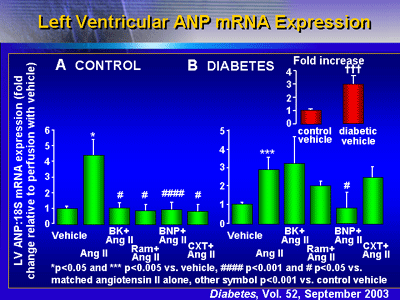
mRNAの発現
加えて、BNPはまた、ANPとβミオシン重鎖のmRNA発現を阻害した。コントロールの心臓では、全ての薬剤がアンジオテンシンII刺激によるANP
mRNAの発現増加を抑制した。糖尿病ラットの心臓では、ベースラインでのANP発現がコントロールと比較して約3倍高かった。アンジオテンシンIIを加えるとさらにANP
mRNAの発現は増加した。BNPはANP mRNAの発現をベースライン近くまで減少させることがわかった(p<0.05;様々な比較で補正するとp=0.16)。その他の薬剤はANP
mRNAの発現増加を有意な程度をもって変化させなかった。
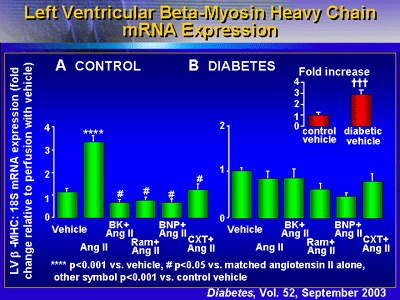
BNPの投与はβミオシン重鎖のmRNA発現を減少させるようにみえたが、これは統計学的有意差をもつまでには至らなかった。
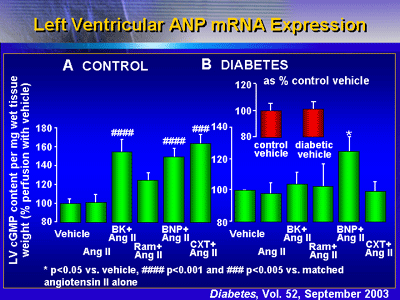
サイクリックGMP
コントロールの心臓においては、全ての薬剤がある程度サイクリックGMPを活性化した。しかしながら、糖尿病ラットの心臓では、BNPのみが有意な活性効果を示した。
Ritchie博士らは、「BNPはアンジオテンシンIIに関連した肥大反応を阻害するが、ブラジキニン、ACE阻害薬、NEP阻害薬は阻害しない」ということを示した。加えて、BNPは糖尿病ラットの心臓のサイクリックGMPを増加させたがこの研究のその他の治療ではそういったことは起こらなかった。これらの知見は、ナトリウムペプチドを投与することは糖尿病における心肥大を抑制する効果的な手段たりうるという仮説を支持する。
|