|
Rabinovitch博士らの研究は、血管病の病理生物学におけるエラスターゼ分解酵素(彼女らはこれを内因性血管エラスターゼと呼んでいる)の中心的な役割に焦点を当てている。
この酵素が放出されると複合的な反応が引き起こされる。エラスチンの分解産物、すなわちエラスチンペプチドによって炎症細胞が集積する。そしてこれらの炎症細胞は血管内腔に入り、エラスターゼや間質メタロプロテアーゼを分泌する。その結果、タンパク分解反応が増幅される。この一連の反応の中で、通常は不活性型の形で貯蔵されている様々な成長因子もまた放出される。
内因性血管エラスターゼ活性を阻害することによって、血管が傷害されるのを予防することが可能であるかもしれない。この研究グループはまず、エラスターゼ阻害薬をげっ歯類の肺高血圧モデルに使用した。
彼女らはまず最初に、心移植後に起こるきわめて進行性の冠動脈病変はエラスターゼ阻害薬で治療可能なのではないか、という仮説について検証した。ウサギの心移植モデルにおいては、血管内腔の一部もしくは内腔のほぼすべてを閉塞するほどの著明な新生内膜がみられた。これに対しエラフィン、すなわち自然に存在するヒトエラスターゼ阻害薬で治療したモデルでは、80%の動脈がもとのまま保たれていた。
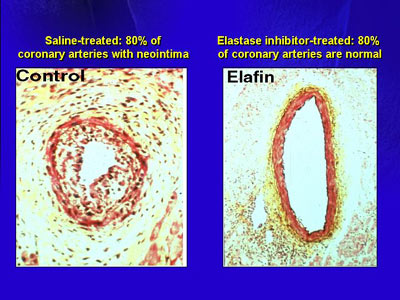
このことが示された後、炎症が関与する血管病におけるエラフィンの役割についての研究がなされた。ウサギにおいて頸動脈の位置に頸静脈を移植し、その静脈に遺伝子操作によって作られた遺伝子組み換え型エラスターゼ阻害薬エラフィンを注入した。
このモデルでは48時間後に炎症が評価された。コントロール群の血管では炎症反応は容易に検出されたのに対し、遺伝子治療を行った動物の静脈ではほとんど炎症細胞は認められなかった。
内膜肥厚については、コントロール群として生食で灌流した静脈では内膜肥厚が明らかに認められた。これに対し、エラフィンの遺伝子治療を行った静脈グラフトでは、内膜肥厚が著明に減少していた(50%にも上る減少が認められたものもあった)。
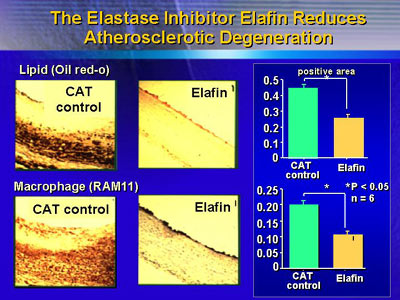
エラフィンにより治療された血管の新生内膜は、アテローム性動脈硬化に対し抵抗性である、と彼女らは推論した。これを証明するため、エラフィンの遺伝子治療を施した静脈グラフトを移植した動物に3ヵ月間、高コレステロール食を与えた。コントロール群の血管では脂質の厚い沈着を認めたが、遺伝子治療を行ったものはコントロール群のたった50%の沈着しか認められなかった。
マウスを用いてさらに研究を行ったところ、血管病を発症しやすいかどうかは、おそらくエラフィンのように内因性に産生されたエラスターゼ阻害物質によって抗エラスターゼ反応が起こりうるかどうかにある程度関係があると考えられた。
肺高血圧モデルを用いた実験では、ある製薬会社が開発した2種類の経口エラスターゼ阻害薬を用いて治療を行ったマウスは、コントロール群より生存期間が1〜2週間長いという研究結果が報告された。肺動脈圧を測定するとコントロール群に比較して肺高血圧の改善が認められた。
このモデルによると、エラスターゼ阻害薬は炎症によって起こる血管病の予防あるいは改善さえももたらしうると考えられたため、これらの薬剤の心筋における炎症過程での効果が検証された。マウスの心筋炎モデルにおいて、無治療のマウスでは顕著な炎症細胞浸潤、さらには石灰化まで認められたが、エラスターゼ阻害薬治療を継続的に受けたマウスではほとんど炎症の所見が認められなかった。
さらに調べてみると、心筋梗塞モデルではエラスターゼ阻害薬治療により心筋組織の治癒に改善が認められた。さらに最近では、おそらくエラスターゼ阻害薬により炎症と線維化が抑制されることにより、心筋梗塞後の構造的・機能的な治癒に改善がもたらされるということがわかっている。
これらの研究結果はたった1つの研究グループによる知見である。このグループに加え、他の研究グループの参画を得ることで、血管病におけるエラスターゼ阻害薬の潜在的な役割がより完全に解明されるであろう、とRabinovitch博士は述べた。
レポーター:Andrew
Bowser
日本語翻訳・監修:京都大学大学院医学研究科循環病態学 尾田知之 |
|